Não é de agora que a curiosidade do homem o faz investigar o universo. O universo abordado nesta postagem é de nível microscópico, o Átomo, assim iniciamos a sua história.
Filósofos Gregos
Demócrito (460-370 antes de Cristo) dentre outros filósofos gregos, imaginavam que a matéria era feita de partículas indivisíveis e extremamente pequenas, das quais denominaram átomos ( indivisíveis em grego).
Algum tempo depois Platão e Aristóteles indagaram a hipótese de que não haveria partícula indivisível.
Já o filósofo Epicuro, fundou uma escola em Atenas, concordava co Demócrito e anos depois Galileu Galilei explicou o aparecimento de uma substância após uma reação química devido ao rearranjo de partes da matéria muito pequenas.
Já o filósofo Epicuro, fundou uma escola em Atenas, concordava co Demócrito e anos depois Galileu Galilei explicou o aparecimento de uma substância após uma reação química devido ao rearranjo de partes da matéria muito pequenas.
Séc. XVII na Europa Ocidental
O conceito de átomo é retomando ao tentar explicar o comportamento e propriedades dos gases no século XVII. Isaac Newton foi um cientistas que defendeu a existência do átomo e Lavoisier compreendeu como a matéria reagia entre si para formar outro material, originando a famosa Lei de Lavoisier " Na natureza nada se cria, nada se destrói, tudo se transforma". Boyle, no final do século XVII, retoma a concepção atomística em seu trabalho com gases com o que chamou de "filosofia corpuscular"
Modelo de Dalton
Apenas por volta de 1808, o inglês, John Dalton publicou a base para a teoria atômica, com seus sete postulados:
- Cada elemento é composto por partes pequenas, maciças, indivisíveis e indestrutíveis denominadas átomos;
- Átomos de um mesmo elemento são idênticos em massa e propriedades;
- Átomos de elementos diferentes são diferentes em massa e propriedades;
- O átomo de um elemento não se transforma em átomos de outro elemento por reação química;
- Átomos não são criados, nem destruídos, apenas rearranjados durante reação química;
- Compostos são formados pela combinação de átomos de mais de um elemento;
- Um determinado composto tem sempre o mesmo número relativo de átomos dos mesmos tipos de elementos.
Os postulados 4 e 5 deram base para a Lei da Conservação da Matéria na qual a massa total fornecida pelos reagentes é igual a massa dos produtos.
- Conheça as Leis ponderais
Modelo de Thomson
 |
| (a) Esquema de um tubo com raios catódicos, (b) tudo com emissão de raios catódicos, (c) raio catódico desviado por um imã. |
Durante o século XIX diversos os estudos com descargas elétricas foram realizados. Até 1855 foram realizados estudos de descargas em dentro de tubos parcialmente evacuados, com aplicação de uma alta voltagem de aproximadamente 10 000V.
Esse sistema, denominado tubo de raios catódicos ou ampola de Crookes, apresentava dois condutores elétricos, um em cada extremidade, denominados eletrodos.
Ao aplicar a alta tensão elétrica e reduzir a pressão no interior do tubo, por uma bomba, o tubo exibia fluorescência ( como mostra a figura (a) e (b) ao lado) denominados raios catódicos, pois sua origem era no catodo (pólo negativo).
J.J.Thomson observou que
- Os raios catódicos se moviam de forma linear, independente do material dos eletrodos e do gás residual.
- Ao inserir um lâmina metálica em formato de moinho no tubo e expô-la aos raios catódicos, a lâmina adquire movimento, indicando que os raios apresentavam energia cinética e consequentemente massa.
- Ao aplicar um campo elétrico, os raios catódicos eram desviados na direção da placa positiva, indicando que os raios apresentavam carga negativa.
 |
| Modelo de Thomson |
Assim deu-se origem ao modelo atômico de Thomson, no qual se considera que os átomos são formados por uma esfera maciça positiva com cargas negativas incrustadas em sua superfície (denominado elétron), que compreendem uma pequena parcela da massa e do volume do átomo.
Esse modelo é conhecido como modelo de Pudim de Passas.
Apenas em 1909 Milikan conseguiu calcular com êxito a carga do elétron
Modelo de Rutherford
Por volta de 1896 Becquerel descobriu a radioatividade e junto com Marie Curie e Pierre Curie iniciaram experimentos com esses materiais radioativos. Posteriormente Rutherford, por volta de 1909-1911, iniciou experimentos com três partículas, sendo que duas sofrem desvios por campo elétrico, como mostra a figura abaixo, no canto direito.
Rutherford, Geiger e Marsden (1910) estudavam o comportamento das partículas alfa, emitidas pelo polônio, ao atravessarem uma lâmina de ouro finíssima, com um anteparo de filme fluorescente.
Esperava-se que todas as partículas alfa não teriam o trajeto desviado, ou com um pequeno desvio, pois as cargas positivas e negativas estariam dispersas uniformemente em cada átomo da folha de ouro.
O que observaram foi que a maior parte das partículas alfa atravessavam a lâmina de ouro sem modificar a trajetória, já uma pequena parcela tinha seu trajeto desviado em 1º.
Para surpresa da comunidade científica uma parcela quase insignificante sofria desvio de alto ângulo ou era totalmente refletida, como mostra a figura ao lado, chegando até a retornar para atrás.
Apenas em 1911, Rutherford conseguiu explicar com os seguintes postulados:
 |
| Comportamento das partículas com campo elétrico |
- partícula alfa: apresentam carga positiva, de valor +2. Combina-se com dois elétrons para formar um átomo de hélio.
- partícula beta: são elétrons (carga negativa), de valor -1.
- partícula gama:alta energia similar ao do raios-X, não apresenta carga.
Rutherford, Geiger e Marsden (1910) estudavam o comportamento das partículas alfa, emitidas pelo polônio, ao atravessarem uma lâmina de ouro finíssima, com um anteparo de filme fluorescente.
 |
| Experimento de Rutherford com lâminas de ouro |
O que observaram foi que a maior parte das partículas alfa atravessavam a lâmina de ouro sem modificar a trajetória, já uma pequena parcela tinha seu trajeto desviado em 1º.
Para surpresa da comunidade científica uma parcela quase insignificante sofria desvio de alto ângulo ou era totalmente refletida, como mostra a figura ao lado, chegando até a retornar para atrás.
Apenas em 1911, Rutherford conseguiu explicar com os seguintes postulados:
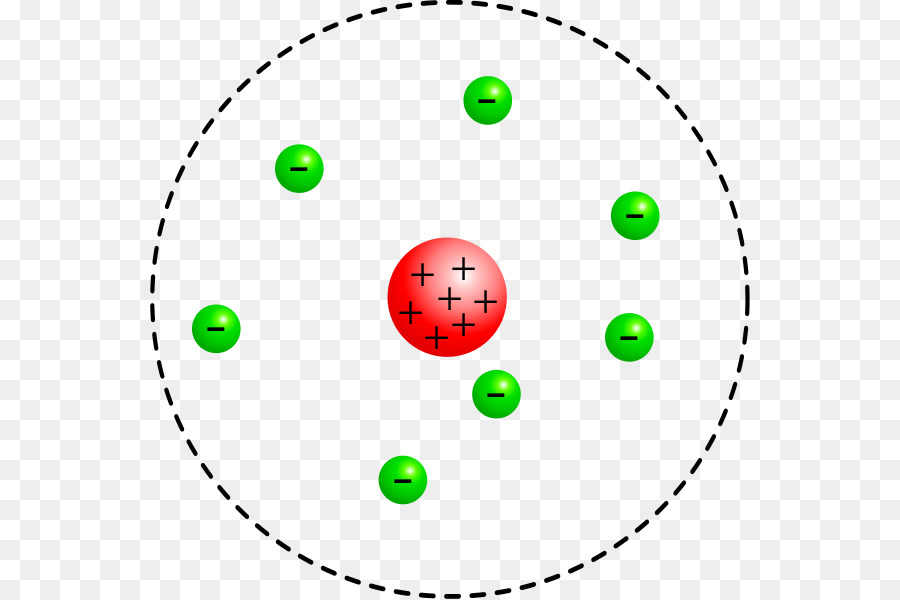 |
| Modelo Atômico de Rutherford |
- A maior parte da massa do átomo está no núcleo.
- O núcleo é uma região extremamente pequena e densa do átomo, com carga positiva. Os pequenos desvios sofridos pelas partículas alfa eram por passarem na vizinhança do núcleo e por repulsão eram desviados.
- Maior parte do átomo é composta por espaço vazio. Por isso as partículas alfa não sofrem desvio.
- Os elétrons se movem nesse espaço vazio, em órbitas circulares.
Modelo de Bohr
Ondas eletromagnéticas são aquelas que não necessitam de um meio material para se propagarem, como a luz visível, ondas de rádio. Observe a figura abaixo:
Um experimento comum é utilizar uma lâmpada incandescente, ou a luz do sol e observá-la ao atravessar um prisma, decompondo a luz em vários espectros bem definidos, formando um arco-íris. Assim observamos todo o espectro de luz visível.
O mesmo não acontece ao utilizar uma lâmpada de gás, como um tubo catódico, que contém gás residual, apenas algumas frequências de ondas será observada. Essas frequências observadas são chamadas de linhas espectrais.
 |
| espectro de linhas |
Dependendo do gás utilizado, será observado uma espectro de linhas diferentes. Observe a figura à direita, o espectro de emissão do hidrogênio é diferente do espectro de emissão do hélio.
Diante disso, Niels Bohr propõem uma novo modelo atômico, que explica os espectros de emissão, dentro da estrutura atômica,com os seguintes postulados:
- Os elétrons se movimentam ao redor do núcleo em trajetórias circulares, denominados camadas ou níveis, designados: K, L, M,N, O, P, Q.
- Cada nível é definido por um valor determinado de energia.
- Não é possível que um elétron permaneça no espaço entre dois níveis.
- Um elétron pode passar de um nível para outro de maior energia, apenas se absorver energia de um agente externo, como radiação ultravioleta, luz visível, calor. Essa movimentação é chamada de excitação eletrônica.
- O retorno do elétron ao nível de origem leva a liberação da energia absorvida na forma de onda eletromagnética, denominado fóton.
- Elétrons em seu estado de menor energia é chamado de estado fundamental.
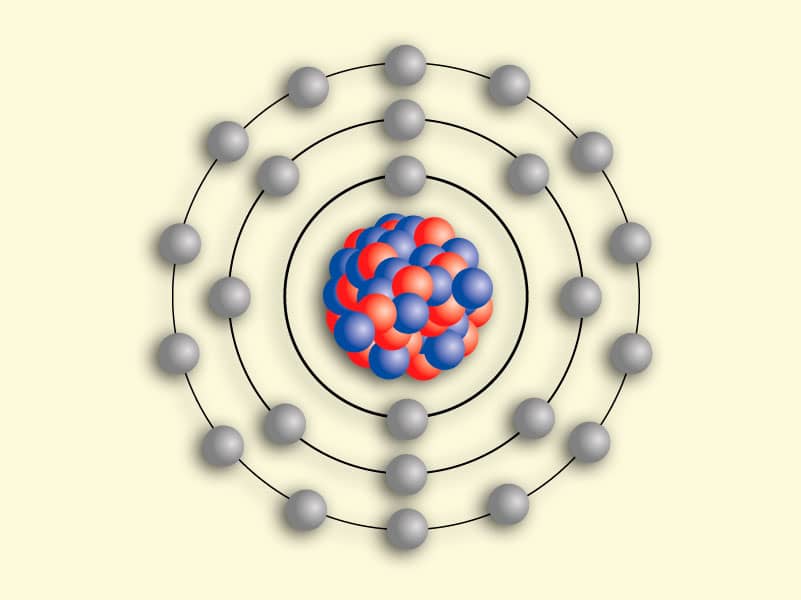 |
| Modelo de Bohr |
Sendo assim, Bohr afirma que os elétrons apresentam energia quantizada, ou seja apresenta valores determinados. O espectro de emissão ocorre quando o elétron absorve uma energia, salta de nível e ao retornar ao seu estado fundamental emite uma linha espectral característica.
Esse sistema de absorção/emissão de energia é o funcionamento dos fogos de artifício e como é possível identificar a presença de elementos com o teste da chama .
Os prótons, partículas presente no núcleo de carga positiva, foi descoberta por Rutherford em 1919, já os nêutrons, partículas presente no núcleo de carga neutra, foi descoberta por Chadwick, em 1923.

